
Les secrets du savon
Comment les particularités de la molécule de savon lui permettent de laver ?
Aujourd'hui, fidèles lecteurs d'Omnilogie, je vais vous révéler les secrets du savon.
Pour ceux qui s'y connaissent un peu en chimie, le savon est composé d'ions carboxylates \(R-COO^-\), constitués d'une longue chaîne carbonée et d'un groupe carboxylate -\(COO^-\).
Pour ceux qui ne s'y connaissent pas en chimie et qui n'ont rien compris à la phrase ci-dessus, disons simplement que la molécule de savon peut être modélisée de la façon suivante :

Les molécules de savon possèdent donc deux parties : la première (en rouge) que l'on surnomme la tête de la molécule et la seconde (en noir) que l'on surnomme la queue. Ces deux parties possèdent des propriétés très différentes :
De ce fait, la molécule de savon est une molécule dite amphiphile(3). Remarquons qu'on pourrait aussi dire qu'elle est amphiphobe(4).
Mais que se passe-t-il concrètement quand vous utilisez du savon ?
La queue de la molécule — lipophile donc — se précipite sur les taches de graisse et entre à l'intérieur, mais la tête lipophobe reste à l'extérieur. On obtient alors une micelle, modélisable de cette façon :
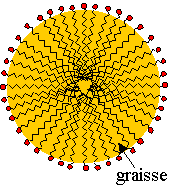
Un fois que vous avez bien savonné, vous rincez et là, que se passe-t-il ? L'eau réagit avec les têtes hydrophiles et les entraîne avec elle, ainsi que la graisse retenue par les queues. Vos mains sont donc propres.