
Pour briser la glace
Comment faire fondre la glace sans la réchauffer ?
Ne cherchez ici nul conseil pour aborder une charmante compagnie, mais plutôt un bref exposé sur une des propriétés étonnantes d'une substance pourtant fort commune : l'eau.
L'eau, comme a priori toute matière, existe en trois états(1), mais nous nous concentrerons sur deux d'entre eux, l'état liquide, le plus commun pour nous, et l'état solide, autrement dit, la glace(2). Plus précisément, c'est à la transition solide-liquide (et inversement) que nous nous intéresserons.
Déjà, certains se lèvent en criant qu'il n'y a là nul sujet d'étonnement, en refroidissant de l'eau, on fait de la glace et, a contrario, en chauffant de la glace, on fait de l'eau.
Bon, et maintenant, si je vous disais qu'il était possible de faire les mêmes transformations, sans modifier la température ?
Eh oui ! De même qu'il est possible de transformer un gaz en liquide en le comprimant beaucoup (c'est le principe des bouteilles de gaz, qui contiennent en fait ledit gaz, mais sous forme liquide(3)), il est possible, en le comprimant énormément, de transformer un liquide en solide.
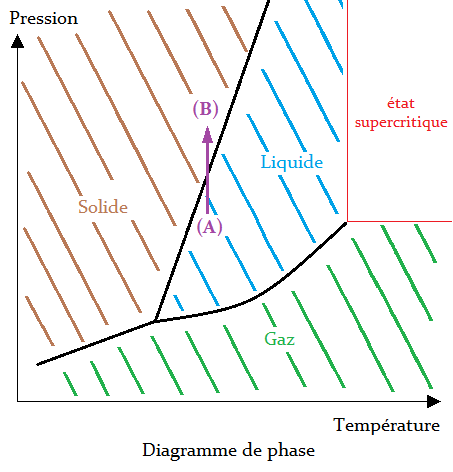
Ce phénomène est visible sur ce type de diagramme : si on prend un point (A), désignant un état liquide, et qu'on augmente la pression sans toucher à la température, on finit par se retrouver en (B), désignant un état solide(4).
Seulement voilà, pour l'eau, c'est un peu différent…
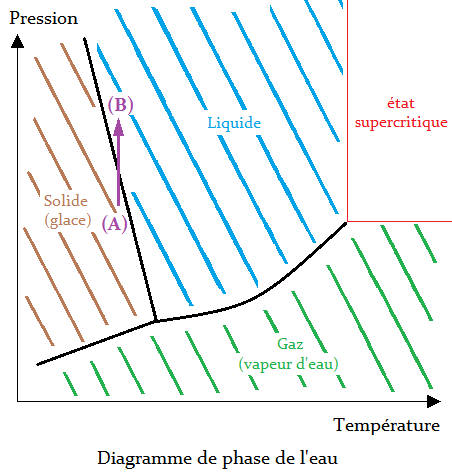
Comme vous pouvez le constater, la droite entre le solide et le liquide se retrouve inversée(5) ! La conséquence directe est que pour l'eau, c'est une dépression qui fait passer du liquide au solide, et par suite, si on comprime de la glace, elle devient liquide.
Pour vérifier ce phénomène, il existe une expérience assez simple, qui consiste à faire passer au-dessus d'un pain de glace un fil avec une masse à chacune des extrémités (1).
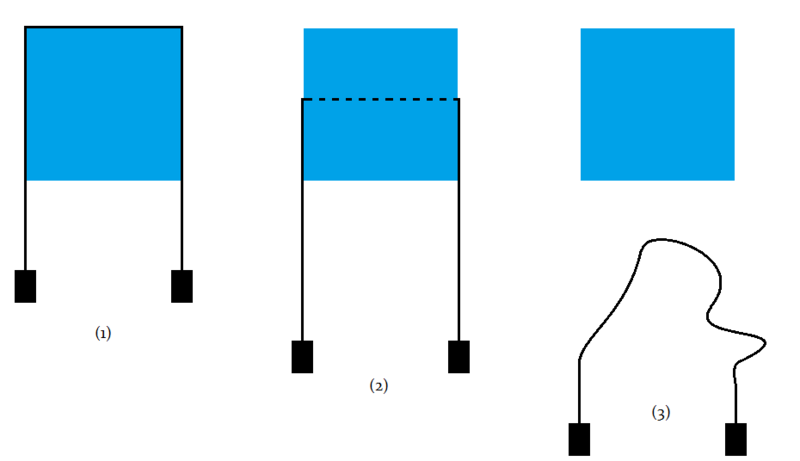
Le fil exerçant une pression sur la glace, celle-ci va se mettre à fondre au niveau du fil, permettant à celui-ci de s'enfoncer dans la glace. Cela dit, la glace fondue (de l'eau liquide, donc) se retransforme en glace immédiatement après le passage du fil, sous l'effet de la basse température du pain de glace environnant (2).
Enfin, le fil parviendra tout en bas du pain de glace, et tombera, laissant le pain de glace qu'il vient de traverser intact (3).
Il est enfin à noter que c'est partiellement ce phénomène qui permet aux patineurs et patineuses artistiques de se mouvoir si aisément sur la surface glacée. Les patins, appliquant une pression sur la surface de la patinoire (de la glace), la transforment localement en eau (liquide), qui engendre très peu de frottements(6), et… zzzzzzzzzzzzzzzzzzzzzzzz(7) !
- (1) ↑ Et même un peu plus que ça !
- (2) ↑ Pour plus de simplicité, dans le reste de l'article, nous les appellerons respectivement « eau » et « glace », même si strictement parlant il s'agit dans les deux cas d'eau.
- (3) ↑ Du coup il est incorrect de dire que c'est un gaz, mais vous me comprenez.
- (4) ↑ Cela dit, sur un vrai diagramme de phase, la pente entre le solide est le liquide est bien plus verticale : il faut une grosse augmentation de pression.
- (5) ↑ Ce phénomène n'est valable que pour des températures pas trop basses, jusqu'à -20 ℃ uniquement.
- (6) ↑ Cette transformation est en fait dûe principalement aux frottements entre le patin et la glace, le phénomène lié à la pression n'étant pas suffisamment important pour faire fondre la glace à lui seul.
- (7) ↑ Boum.