
De quoi sentir bon
Comment fabrique-t-on un savon ?
Le savon est un élément indispensable dans toute salle de bain. Cependant, on ignore souvent comment il est fabriqué.
Tout se résume par cette équation chimique : celle de la saponification.
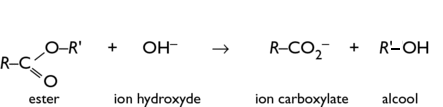
Les R et R' désignent des groupements constitués d'une chaine de carbones liés entre eux portant chacun deux atomes d'hydrogène, et en bout de chaine on trouve un carbone lié à trois hydrogènes.
Notre savon est en fait cet ion carboxylate, tandis que l'ester que l'on utilise correspond à de la graisse.
Cette simplicité a permis aux gens vivant à l'arrière pendant les deux guerres mondiales de pouvoir se laver en réutilisant les graisses alimentaires, en la trempant dans de l'eau chaude avec de la soude(1).
On peut se demander pourquoi il y a une telle réaction.
Le carbone « central » de l'ester est un site dit électrophile (receveur d'électrons). Il va donc facilement réagir avec des nucléophiles (donneurs d'électrons) tel que HO-.
Toutefois, la molécule obtenue est instable donc un des groupements va devoir partir. Le meilleur candidat(2) étant R'-O-.
Enfin, l'ultime étape s'explique par les pKa des couples acides/bases(3),
or \(p{K_a}(\mbox{acide carboxylique/ion carboxylate}) < p{K_a}(\mbox{alcool/ion alcoolate})\) d'où la transformation de l'ion alcoolate R'-O- en alcool R'-OH(4).
On obtient ainsi le savon.
La température va toutefois influer sur la réaction. Même si cette dernière est exothermique(5), si les réactifs sont chauffés, la réaction prendra une trentaine de minutes contre trois semaines dans le cas contraire.
- (1) ↑ Hydroxyde de sodium Na-OH soit un ion sodium Na+ et un ion hydroxyde HO-.
- (2) ↑ Celui qui, en partant, donne une stabilité maximale à la molécule.
- (3) ↑ \(pK_a=-log(K_a)\), \(K_a\) la constante d'équilibre de la réaction acide vers base, plus le pKa est grand plus l'acide est fort.
- (4) ↑ Et donc la transformation de l'acide carboxylique R-CO2H en ion carboxylate R-CO2- ou savon.
- (5) ↑ Elle produit de la chaleur.