
Il est pas beau, mon Graal ?
À quoi sert une mole ? À trouver le Graal !
Connaissez-vous le Nombre d'Avogadro ? Ce nombre, noté Na, est une constante chimique qui vaut $6,02×10^{23}$, et qui définit la mole, notion très utilisée en chimie.
Qu'est-ce qu'une mole ?, me demanderez-vous. Eh bien, c'est un nombre d'objets : une mole de patates fait $6,02×10^{23}$ patates(1). Alors bien entendu, ça en fait beaucoup, mais généralement on n'utilise pas la mole pour dénombrer des patates (ni des tomates, ni des courgettes, enfin vous m'avez compris), mais des molécules, qui sont beaucoup plus nombreuses(2).
C'est d'ailleurs des molécules que vient la définition de la mole, qui paraît étrange de prime abord : si on veut juste compter beaucoup d'objets en même temps, pourquoi ne pas prendre juste \(10^{23}\) ? Eh bien, une mole correspond exactement au nombre d'atomes de carbone dans 12 grammes de carbone 12 (la forme la plus courante du carbone).
Ça nous fait une belle jambe, direz-vous. Mais cette équivalence en entraîne une autre, plus intéressante : la masse (en gramme) d'une mole de n'importe quelle substance est égale à la masse (en dalton(3)) d'une molécule de cette substance.
Par exemple, une mole d'eau pèse environ 18 grammes ; et une molécule d'eau pèse 18 dalton.
Au-delà de ces considérations scientifiques, le nombre d'Avogadro est grand, très grand même, bien plus que ce qu'on peut imaginer. Jugez vous-mêmes : si on prenait une mole de pop-corn, et qu'on l'étalait consciencieusement en une couche uniforme sur toute la surface des États-Unis, on obtiendrait une couche épaisse de… 14 kilomètres.
Bon, c'est bien beau tout ça, mais c'est quoi le rapport avec le Graal ?
Eh bien le rapport vient du fait qu'avec de telles quantités, on peut s'amuser avec les probabilités !
Prenons donc le Graal, c'est-à-dire la coupe utilisée lors de la Cène.

Le volume d'un verre d'eau est d'environ 25 centilitres, ce qui correspond à 250 grammes (avec une masse volumique de 1 g/mL), ce qui donne environ 13,8 moles de molécules d'eau (avec une masse molaire de 18 g/mol), soit $8,3×10^{24}$ molécules d'eau.
Bon, dans le Graal, ce n'était pas de l'eau qu'il y avait, mais du vin. Cela dit, le vin est composé à peu près à 80 % d'eau, ce qui nous fait donc grosso-modo $6,6×10^{24}$ molécules d'eau.
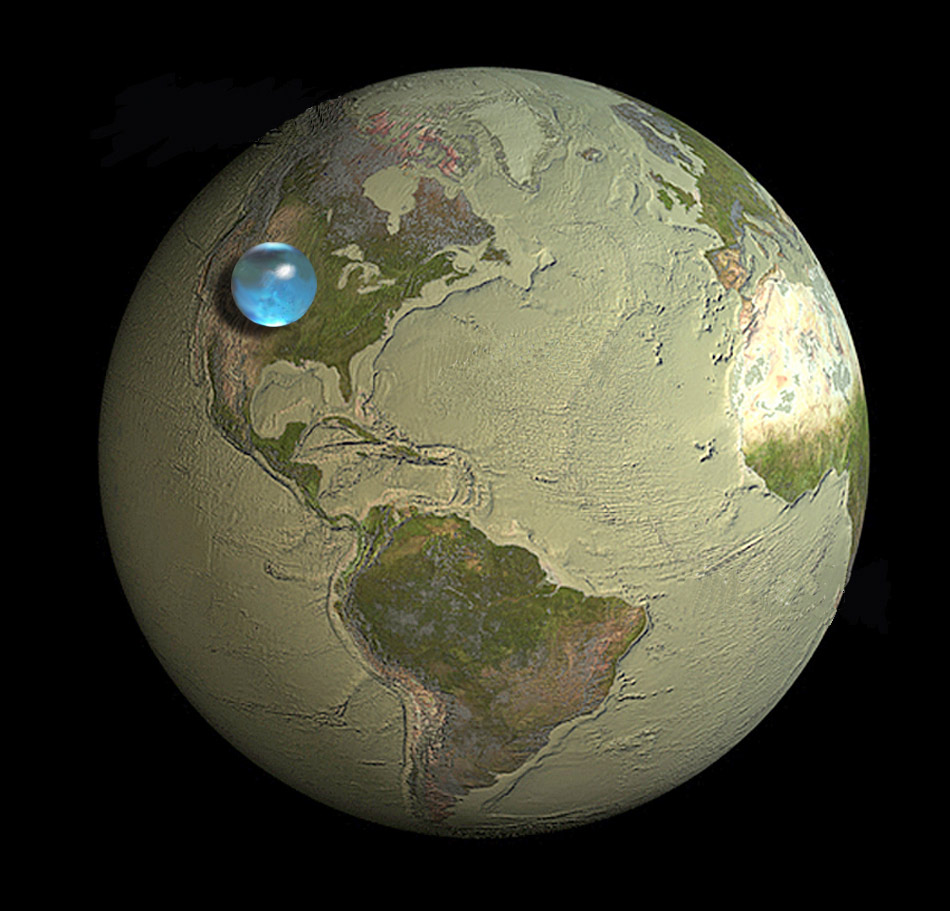
Si toute l'eau de la Terre était regroupée en une bulle unique…
Considérons maintenant le volume d'eau total disponible sur Terre : environ $1,386×10^{21}$ litres (ce qui ne fait pas grand-chose comparé au volume de la Terre elle-même).
En prenant toujours un verre d'eau d'un volume de 25 cL, cela correspondrait à environ $5,6×10^{21}$ verres d'eau.
Vous ne remarquez rien ? Si : ce nombre est inférieur au nombre de molécules dans notre Graal, et même environ mille fois inférieur.
Si on considère qu'après 2 000 ans, ces molécules ont été également réparties dans toutes les eaux de la planète(4), on arrive à un constat assez amusant : dans chaque verre d'eau (de celui qu'on vous sert au restaurant à celui que vous vous tirez du robinet), il y a en moyenne 1000 molécules d'eau qui étaient également dans le Graal.
Alors franchement, ça vaut pas la peine de courir après ça(5)…
- (1) ↑ Purée…
- (2) ↑ Que les patates. Vous suivez ?
- (3) ↑ L'unité de masse utilisée pour les molécules.
- (4) ↑ Ce qui est probablement faux ; de plus, on ne considère pas l'eau qui aurait pu éventuellement se transformer suite à des réactions chimiques ; cela dit, l'expérience de pensée n'en perd rien de son intérêt.
- (5) ↑ Surtout que bon… pour un bocal à anchois…